|
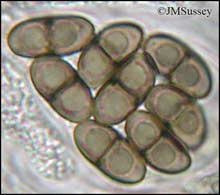
Spores d'Amandinea punctata
Montage dans l'eau (JM Sussey)

Spore de Pyrenula chlorospila
Montage dans le lactophénol
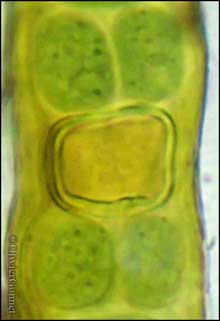
Hétérocyste de Stigonema
d'un thalle d'Ephebe lanata
Montage dans l'eau (O. Gonnet)
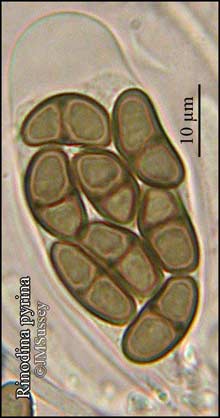
Asque et spores de
Rinodina pyrina
Montage dans l'eau
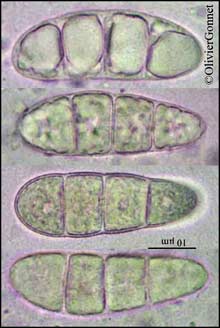
Spores de Thelidium papulare
Montage dans l'eau
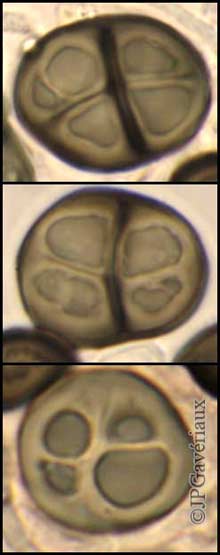
Spores de Cyphelium notarisii
(Chloral lactophénolé)

Spore de Solorina saccata
(montage dans l'eau)
Photo Olivier Gonnet
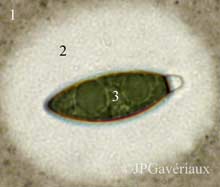
Gaine mucilagineuse (2)
d’ascospore (3) mise en
évidence
dans l’encre
de chine diluée (1)
qui ne pénètre
pas dans le mucilage |
a)
L'eau : le plus simple de ces milieux
d'observation est l’eau. Très utilisé par les mycologues et les lichénologues pour de nombreuses vérifications de routine, ce milieu
d'observation, qui ne détruit rien (sauf les pigments hydrosolubles
mais ils sont exceptionnels), ne modifie pas les couleurs ; c'est
le seul milieu qui permet l'étude des cellules vivantes sous
l'objectif à immersion (H. O. Baral a décrit le mécanisme
d'expulsion des spores chez de nombreux Ascomycètes en observant les
asques montés dans l'eau à l'aide d'un objectif x100
planapochromatique ouvert à 1,40 et d'un oculaire x15.
Remarque : l'eau SDS à 1%
Il est parfois difficile de faire entrer les coupes dans l'eau.
Il suffit alors de prendre de l'eau additionnée d'un détergent ou
mieux de Sodium Dodécyl Sulfate (SDS), un agent
tensio-actif anionique qui rend la solution plus mouillante.
Composition de l'eau SDS à 1%
:
Eau bidistillée
................................... 99 mL
SDS .................................................. 1 g

Coupe
de thalle de Sticta limbata - montage dans l'eau (Olivier
Gonnet)
Le
milieu aqueux présente toutefois plusieurs inconvénients
- Évaporation assez rapide sous l'action de la chaleur dégagée par
le système d'éclairage du microscope et nécessité de remettre de
l'eau si l'observation se prolonge.
- Déplacement des petits éléments isolés (ex : spores) lors des
mouvements d'eau entre la lame et la lamelle.
- Modification des formes : les cellules possèdent des poches, les
vacuoles, remplies de substances diverses dissoutes dans l'eau ; les
vacuoles des cellules sont des milieux concentrés qui attirent l'eau
(phénomène de turgescence) ; l'eau entre donc dans les vacuoles, les
distend et provoque une augmentation de volume des cellules ; il
n'est donc pas possible d'utiliser ce milieu pour évaluer la taille
des éléments à observer (l'utilisation d'eau sucrée ou salée à 8-12%
évite ces phénomènes de gonflement des cellules mais suite à
l'évaporation partielle de l'eau, des courants se créent et on
assiste à des déplacements gênants).
- Indice de réfraction (n = 1,33) très inférieur à celui du verre (n
= 1,515) avec deux conséquences :
a) les éléments hyalins, c'est-à-dire à la fois incolores et
transparents, qui possèdent le même indice de réfraction que l'eau
ne sont pas visibles ;
b) les rayons lumineux traversent une couche d'eau ayant un indice
de réfraction inférieur à celui de la lame et de la lamelle ce qui
ne permet pas d'exploiter correctement l'ouverture numérique des
objectifs pour microscope (voir article précédent).
Il
est donc indispensable de recourir à d'autres milieux d'observation
comme l'eau glycérinée, le lactophénol, le chloral hydraté, le chloral-lactophénolé,
les bases fortes… Plus l’indice de réfraction d’un milieu se
rapproche de 1,515 (indice de réfraction du verre), plus ce milieu
est éclaircissant.
b) Eau
glycérinée :
milieu de montage et d’observation utilisé en microscopie optique ;
il remplace très avantageusement l’eau en évitant une évaporation
trop rapide qui nuit à la qualité de l’observation. La formule la
plus simple est l’eau glycérinée à 8% ; celle de Clémençon beaucoup
plus élaborée est toutefois préférable, surtout pour l’étude des
exsiccata.
Préparation de l’eau glycérinée selon Clémençon : 80 mL d’eau -
0,8 g de pastille de potasse (légèrement regonflant) - 0,8 g de NaCl
(équilibre osmotique) - 0,5 g de mouillant (SDS) - 0,5 g de phénol
(conservateur) - 20 g de glycérine.

Spore
de Phaeographis dendritica - montage dans l'eau glycérinée
c)
Le lactophénol a un indice de réfraction
de 1,44 ; de conservation indéfinie, c'est également un bon
regonflant (voir produits de réhydratation).
Préparer le lactophénol
sous la hotte aspirante dans un ballon dont le col est couvert
d'un verre de montre en utilisant l’agitateur magnétique jusqu'à
obtention d'une solution homogène.
Eau bidistillée ................... 20 mL
Glycérine .......................... 40 g (33,3 mL)
Acide lactique ................... 20 g (16,6 mL)
Phénol ............................. 20 g
d)
Le chloral hydraté a un indice de
réfraction de 1,510 ; il regonfle également les tissus fongiques
mais cette solution aqueuse s'altère rapidement ; il est nécessaire
de renouveler fréquemment la préparation.
Composition
Chloral hydraté
..............................................................
5 g
Eau bidistillée
................................................................
5 g
Les éléments observés dans le
lactophénol ou le chloral hydraté ne sont pas déformés (tailles
mesurées avec précision) et les préparations sont bien
transparentes. Ils donnent toutefois un mauvais contraste et sont
employés le plus souvent en association avec ou, après action d’un
colorant ou d’un réactif microchimique.
Contrairement à l’eau qui
s’évapore rapidement et ne permet que des montages temporaires, ces
milieux de montage visqueux permettent la réalisation de
préparations qui se conservent plusieurs semaines (préparations
semi-permanentes).
e)
Le Chloral au Lactophénol est très
certainement l’un des meilleurs milieux d’observation actuellement
disponible. Il présente plusieurs avantages :
- Une bonne viscosité qui empêche l’évaporation avec la chaleur des
lampes ce qui évite de remettre du liquide de montage en cas
d’observation prolongée.
- Un indice de réfraction élevé (n = 1,49) permettant d’exploiter
avec succès les objectifs et condenseurs corrigés pour les
aberrations géométriques et chromatiques.
- Une bonne lisibilité de la coupe en donnant des contours précis ce
qui facilite les mesures.
- L’hydrate de chloral ramollit les structures, ce qui rend la
dissociation plus facile que dans le lactophénol (dont l’indice de
réfraction n’est que de 1,44).
Composition du Chloral-Lactophénolé
Hydrate de chloral
....................................................... 40 g
Phénol
.........................................................................
20 g
Acide lactique ............................................. 80
g (66,6 mL)
Préparation sous la hotte (reliée à l'extérieur) placer sur l’agitateur
magnétique jusqu’à obtention d’un milieu incolore et transparent.
Conserver dans des flacons fumés (le phénol est sensible à certaines
radiations) bien fermés (limiter l’oxydation et l’absorption de
vapeur d’eau qui entraînerait une dilution du milieu).
f)
La potasse KOH à 10% dans l'eau bidistillée ne modifie pratiquement pas la taille des cellules et le
montage dans KOH à 10% est recommandé pour mesurer avec précision
les asques, spores, renflement des paraphyses…
Cette
solution absorbe le dioxyde de carbone atmosphérique,
devient progressivement inefficace et doit être remplacée lorsqu’un
trouble apparaît. Il est conseillé de posséder une petite réserve de
pastilles de potasse (10 grammes suffisent pour de nombreuses
années) et de dissoudre quelques pastilles dans un peu d’eau bidistillée afin de renouveler la dilution.
Remarque :
ces différents milieux d'observation sont également utilisés pour
placer les substances chimiques (colorants, réactifs…) qui nous
permettront de rechercher les diverses structures.
g) L'eau salée et l'eau
sucrée : bien que ces substances ne
soient pas des colorants on peut les citer ; les
cellules montées dans ces milieux concentrés perdent l'eau de leurs
vacuoles, les pigments vacuolaires restent par contre prisonnier
dans un volume plus petit ce qui intensifie la coloration des
vacuoles et permet éventuellement de localiser un pigment (qui n'est
pas toujours cytoplasmique, membranaire ou incrusté dans les
parois). |
![]()
![]()